국내 완전한 세포치료의약품은 ‘콘드론’ 단 하나...시판후조사 승인으로 안전성 및 유효성 재입증
금번 ‘콘드론’의 시판후조사 승인은 2001년 국내 생명공학의약품 제1호 ‘콘드론’의 실용화 이후, 불특정 다수의 환자를 대상으로 한 광범위한 사용경험을 통해 최종 검토를 완료한 것으로, ‘콘드론’이 의약품으로서 90% 이상의 안전성 및 유효성을 재검증 받았다는데 큰 의의가 있다.
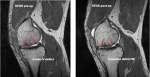
2001년 1월부터 2005년 11월까지 진행된 ‘콘드론’ 시판후조사의 평가기준은 환자 무릎의 수술 전(Knee society score) 값과 수술 6개월 후 측정한 값을 비교하여 최종 유효성 평가를 하였으며, 작용의 종류와 발현상황, 부작용의 정도, 인과관계 및 질병이 진행된 경과 등을 수술 후 6개월간 관찰한 것이 토대가 되었다.
국내 대학병원을 포함한 80개 주요기관에서 작성한 자료에 따르면, ‘콘드론’을 이용한 연골재생 세포치료를 시행한 환자의 ‘콘드론’ 주입 전과 주입 후 6개월 이상의 경과를 비교 분석한 결과, KSS-A의 경우 양호 이상의 결과를 보인 환자는 97.3%로 나타났으며, KSS-B의 경우 89.3%에서 양호 이상의 판정을 받은 것으로 나타났다.
이로써 ‘콘드론’은 어떠한 제도적 제약 없이 시판이 가능한 완전한 제품으로서의 면모를 갖추게 되었으며, ‘국내 생명공학의약품 제1호’ 타이틀에 이어 시판허가 후 시판후조사 승인까지 받은 국내 최초의 세포치료제로 이름을 올리게 되었다.
국내 생명공학의약품 제1호, ‘콘드론’
세원셀론텍㈜이 세계 두 번째로 개발한 개인맞춤형 관절치료제 ‘콘드론’은 지난 2001년 식품의약품안전청으로부터 제품허가를 받음으로써 의약품 개발의 오랜 숙원인 ‘대한민국 생명공학의약품 제1호’를 탄생시키는 개가를 이루었다.
‘콘드론’은 현재1,000여명의 관절질환 환자를 치료하여 국민 관절건강에 큰 일익을 담당하고 있다.
‘콘드론’은 관절 연골손상의 최우선 치료법인 연골세포의 생체 외 증식을 이용, 정상적인 무릎연골로 재생시키는 세포치료제로서, 6~12주 후면 정상적인 무릎연골이 재생되어 걸을 수 있고, 18개월 후면 운동이나 자전거 타기 등 강도 높은 운동이 가능해지는 혁신적인 치료제이다.
조직공학에 대한 개념조차 전무하던 대한민국에서 세계 두 번째로 이루어진 세원셀론텍㈜의 ‘콘드론’ 제품허가라는 획기적인 성과는, 현재의 줄기 세포 및 조직공학 붐을 형성하는 기폭제 역할을 하였다. 또한 이로 인해 세포치료제 허가모델을 탐구하기 위한 선진각국의 한국 방문이 줄을 이었으 며, BT산업 육성을 위한 생물의약품과의 신설 및 보건복지부, 산업자원부, 과학기술부의 관련 연구펀드를 조성하는 혁신적인 기반을 마련하기도 했다.
이와 같이 세원셀론텍㈜은 ‘줄기세포’와 ‘세포치료제’에 대한 첨단의 개념을 국내에 처음 뿌리 내리고 국가적 관심과 역량을 집중시키는데 결정적인 역할을 하였다.
순수 산업체 단독연구의 저력이 일군 한국 바이오산업의 개가 5년여 연구개발 성과 줄기찬 결실
세원셀론텍㈜은 지난 2005년 12월 6일, ‘콘드론’의 적응증 확대를 위한 족관절 연골결손 연구자임상시험을 식품의약품안전청으로부터 승인 받은 바 있으며, 이번 달 시행에 들어갈 예정이다. 본 연구자임상은 국내 족부정형외과 권위자인 노원을지병원 이경태 교수의 주관 하에 이루어지며, ‘콘드론’이 향후 인공관절 치환술을 대체해 발목관절 환자에게도 적용될 수 있는 기반을 마련할 것으로 예상된다.
이에 연이어 지난 2005년12월 19일에는 식품의약품안전청으로부터 성체줄기세포치료제 ‘오스템’의 세계최초 제품화 임상시험을 승인 받는 쾌거를 이루었다. 현재까지의 줄기세포 활용에 대한 연구가 학문적인 성과를 목적으로 둔 반면, 본 줄기세포 임상시험은 제품화를 목적으로 3년이라는 긴 시간 동안 공식적인 검증단계를 거친 것으로, 1년 이내 실용화가 가능할 것으로 전망되며, 약 5조에 달하는 골 재생 관련 세계시장에서 블록버스터 신약으로 자리매김 할 것으로 큰 기대를 모으고 있다.
계속해서 세원셀론텍㈜은 2005년12월28일에 개인맞춤형 뼈치료제 ‘오스템’의 대퇴골두 무혈성괴사증을 대상으로 한 연구자임상시험을 식품의약품안전청으로부터 세계최초로 승인 받았다. 본 연구자임상은 강남성모병원 김정만 교수의 주관 하에 이번 달부터 시행될 계획이며, 특 별한 치료방법이 없어 사회적, 경제적으로 큰 문제점을 야기하고 있는 대퇴골두 무혈성괴사증의 치료를 통해 향후 국민보건 향상에 크게 기여할 것으로 예상된다.
세계최초 성체줄기세포치료제 제품화 임상승인, 그리고 ‘콘드론’과 ‘오스템’의 적용범위 확대 기반 마련에 이어 금번 ‘콘드론’의 시판후조사 승인에 이르기까지, 한국 바이오산업의 청신호를 연거푸 켜나간 데 대해 세원셀론텍㈜ 장정호 회장은 “지난 5년간 묵묵히 다져온 연구개발 노력의 성과가 줄기차게 결실을 맺고 있는 것”이라며, “세계적인 제품과 탄탄한 인프라를 기반으로 한 세원셀론텍은 한국 바이오산업 회생의 강력한 대안, 그 중심에서 획기적인 전환점을 마련해갈 것”이라고 피력했다.
시판후조사(PMS)제도란?
현행 시판후조사(PMS)제도는 약사법 제26조 2항 및 식약청에서 정한 ‘신약 등의 재심사기준’에 따라 신약 시판 후 4∼6년 동안 600∼3,000례의 환자에 대해 병·의원 등에 조사를 의뢰해 자료를 수집, 해당 의약품에 대한 사용경험을 제출하도록 되어 있다.
이는 신약 상품화 이후 불특정 다수의 환자들을 대상으로 한 광범위한 사용 경험을 통해 얻은 부작용 또는 새로운 효능 등의 자료를 체계적으로 수집·평가해 신약 개발과정에서 발견치 못한 안전성 및 유효성을 확인, 검토하기 위한 것이다.
웹사이트: http://www.sewoncellontech.com
연락처
세원셀론텍(주) IR팀 강양숙 02-2167-9174
세원셀론텍 IR팀 한상덕 팀장(016-204-1485) / 강양숙 (016-559-9603)